
‘파열된 신뢰’ 인공유방...국내 이상사례 4천3백 건
2018년 11월 27일 09시 22분
한국탐사저널리즘센터-뉴스타파와 국제탐사보도언론인협회(ICIJ) 협업취재팀이 인공유방 보형물의 부작용을 보도한 지 9개월이 흘렀다. 우리 규제당국도 뒤늦게나마 암 발생 위험성이 제기된 제품 퇴출 대책을 내놨다. 인공유방 보형물 외에도 ‘인체이식형 의료기기’ 추적관리 시스템도 강화하겠다고 밝혔다.
식품의약품안전처(처장 이의경)는 지난 8월 29일 국내 의료기관에 모든 종류의 거친 표면 인공유방 보형물 사용 중지를 요청했다고 밝혔다. 면역계 암의 일종인 ‘유방보형물 관련 역형성 대세포 림프종’(이하 BIA-ALCL)을 유발할 수 있다는 위험성이 꾸준히 제기된 엘러간사의 ‘거친 표면 인공유방 보형물’이 리콜(회수)된 지 한 달만이다. 국내에서도 최초로 BIA-ALCL 환자가 발견된 뒤로는 보름이 지난 시점이다.
엘러간 외에도 6개사의 제품 8종이 사용 중지 대상이다. 이 6개 업체가 제조한 거친 표면 보형물 이식 케이스에서 BIA-ALCL 확진환자는 발견되지 않았지만 해외 연구에 따르면 대부분 거친 표면 보형물을 이식한 환자들에게서 이 림프종이 발견됐다.
엘러간은 8월 30일 ‘바이오셀 내트럴’(Biocell Natrelle) 제품군의 거친 표면 인공유방 보형물을 이식받은 환자들에 대한 보상 방안을 식약처에 제출할 계획이라고 밝혔다. 식약처는 엘러간의 보상 방안을 검토한 뒤 9월 중 최종안을 확정 발표할 계획이다.
식약처는 또 BIA-ALCL 의심 증상으로 병원을 찾는 환자들에 대한 추적 관리를 강화하겠다고 밝혔다. 환자들이 검진을 받으면 환자 정보와 검진 결과를 한국의료기기안전정보원에 등록해 모니터링하고 피해보상까지 이어지도록 지원하겠다고 했다.
뉴스타파는 지난해 11월부터 인체이식형 의료기기의 부작용을 연속보도하고 있다. 식약처의 관리 부실과 추적관리 시스템의 문제점도 꾸준히 지적했다. 식약처는 이번 인공유방 사태 관련 대책 마련과 함께 추적관리 대상 의료기기 관리 제도도 뒤늦게나마 개선하겠다고 발표했다. 현행 의료기기법은 부작용 등이 발생하면 인체에 치명적인 위해를 줄 수 있는 스텐트, 인공관절 등 인체이식형 의료기기 52종을 추적관리 대상으로 지정하고 있다. 식약처는 향후 환자들도 자신의 몸에 이식한 기기 정보를 확인할 수 있는 창구를 만들겠다고 약속했다. 그동안 추적관리 의료기기의 유통 내역과 부작용 발생 이력 등은 제조·수입사와 의료기관만 조회할 수 있었다.
식약처는 현재까지는 추적관리 의료기기 유통 과정을 납품된 의료기관 단계까지만 파악할 수 있고, 실제 이식환자까지는 확인할 수 없었다고 주장했다. 이제 의료기관이 의료기기 이식 환자 정보와 부작용 발생 이력까지 매달 식약처에 보고하도록 의료기기법 시행규칙을 개정하겠다는 게 식약처의 설명이다. 뉴스타파 확인 결과 식약처의 주장은 반은 맞고, 반은 틀렸다.
사실, 의료기기 이식환자 추적을 가능케 할 전산 시스템은 이미 구축돼 있는 상태다. 식약처가 운영하는 의료기기추적관리시스템은 추적관리대상 의료기기를 취급하는 업체와 의료기관 관계자가 로그인해 직접 이식에 사용한 기기 정보뿐 아니라 환자 정보까지 입력하도록 구성돼 있다.
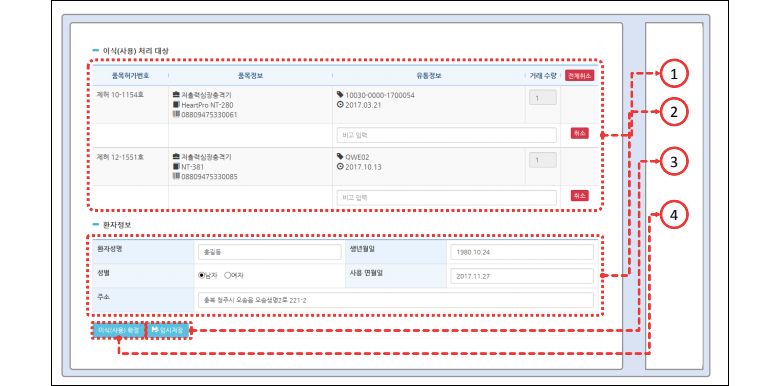
식약처와 의료기관이 환자 정보를 축적할 법적 근거도 마련돼 있었다. 현행 의료기기법 시행규칙 제50조는 이미 병원이 환자 이름과 성별, 주소, 생년월일 등 개인정보와 이식받은 기기 고유의 제조번호, 이식받은 의료기관 정보를 모두 보관하도록 하고 있다. 문제는 식약처에 정기적으로 보고할 의무가 없었다는 점이다. 식약처가 자료를 요구할 때에만 10일 안에 제출하도록 정해뒀을 뿐이다.
의료기관에 보고 의무를 강제하지 않다 보니 환자 정보를 파악할 수 있도록 설계된 전산 시스템도 제구실을 못한 것이다. 동시에 식약처의 관리·감독도 느슨해 졌다. 그래서 이번 인공유방 보형물 사태가 터진 뒤에도 식약처는 문제의 보형물 이식환자 전수를 파악하지 못하고 허둥지둥했다. 뉴스타파는 식약처가 뒤늦게 약속한 대로 의료기기법 시행규칙 개정이 제대로 이뤄지는지 계속 확인하고 감시할 계획이다.
지난해 11월부터 뉴스타파의 ‘인체이식 의료기기의 비밀' 프로젝트가 진행되면서, 식약처는 지난 4월 의료기기 리콜 정보 공개 기한을 무기한으로 늘리고, 인체이식형 의료기기 이식 후 몸에 발생하는 이상사례 내용을 공개하는 등 안전성 정보공개 제도를 손질한 바 있다. 제도 개선 이전, 식약처는 의료기기 리콜 정보는 3개월만 홈페이지에 게재한 뒤 비공개 처리했고 이상사례 보고 내용은 아예 공개하지 않았다.

앞서 뉴스타파는 식약처가 발 빠르게 대책 마련에 나선 해외 보건당국과는 달리 엘러간 사 거친 표면 보형물에 대한 사용중지, 허가취소 등 선제적 조치에 나서지 않고 BIA-ALCL에 대한 정보 또한 축소 제공한 사실을 지적해 보도했다.
프랑스, 캐나다, 호주 등 해외 보건 당국은 지난 8개월 동안 이식 환자들을 대상으로 한 추적 조사에 착수하고 문제의 제품 사용·판매를 중지하는 등 신속한 조치를 단계별로 밟았다. 지난해 11월 말 뉴스타파를 비롯한 프랑스 르몽드, 미국 NBC 등 ICIJ 국제협업팀이 동시에 보도한 인공유방 보형물 부작용 보도를 민감하게 받아들인 것이다.
프랑스 국립의약품안전청(ANSM)은 지난해 12월에 이미 엘러간을 포함한 모든 제조사의 거친 표면 보형물 제품군 대신 표면이 매끈한 스무스 제품을 사용하라고 의료인들에게 권고했다. 같은 달 엘러간의 거친 표면 보형물이 유럽 CE마크(유럽연합 통합규격 인증 마크) 재인증에 탈락해, 유럽연합 회원국 외에도 CE마크를 준용하는 국가에서 판매가 제한됐다. 프랑스 ANSM과 캐나다 보건국(Health Canada)은 지난 4월 엘러간 제품 판매를 아예 중지시켰다. 아시아권에서는 싱가포르가 5월 10일 엘러간 제품 판매 금지를 결정했다. 지난 6월, 호주도 엘러간이 리콜을 결정하기 전에 미리 엘러간 제품을 포함한 거친 표면 유방 보형물 25종의 판매 중지 검토에 나선 바 있다.
| 취재 | 김지윤 홍우람 |
뉴스타파는 권력과 자본의 간섭을 받지 않고 진실만을 보도하기 위해, 광고나 협찬 없이 오직 후원회원들의 회비로만 제작됩니다. 월 1만원 후원으로 더 나은 세상을 만들어주세요.